
Zakład Biotransformacji
KIEROWNIK
PRACOWNICY
Doktoranci
- mgr Michał Bochynek | Pokój: 2.21, Telefon: +48 71375 7062
- mgr Dorota Misiorna | Pokój: 2.21, Telefon: +48 71375 7062
- mgr Liliana Cebula | Pokój: 2.23, Telefon: +48 71375 7976
INFORMACJE KONTAKTOWE
- Kierownik Zakładu: dr hab. Dorota Dziadkowiec | Pokój: 2.20, Telefon: +48 71375 6238
- prof. dr hab. inż. Marcin Łukaszewicz | Pokój: 2.19, Telefon: +48 71375 6250
- dr hab. Anna Krasowska | Pokój: 2.18, Telefon: +48 71375 6426
- dr Sławomir Jabłoński | Pokój: 2.21, Telefon: +48 71375 7062
- dr Daria Derkacz | Pokój: 2.23, Telefon: +48 71375 7976
- mgr Filip Kot | Pokój: 2.21, Telefon: +48 71375 7062
- mgr Błażej Przystajko | Pokój: 2.21, Telefon: +48 71375 7062
TEMATYKA BADAŃ
Badania prowadzone w Zakładzie Biotransformacji skoncentrowane są wokół kilku głównych wątków, realizowanych w ramach trzech zespołów badawczych.
Rola mediatorów homologicznej rekombinacji w replikacji i naprawie DNA oraz utrzymaniu integralności genomu Schizosaccharomyces pombe i Saccharomyces cerevisiae.
Homologiczna rekombinacja to bardzo istotny mechanizm, który pozwala na wymianę materiału genetycznego pomiędzy homologicznymi sekwencjami. Bierze ona udział w procesach takich jak naprawa podwójnych pęknięć DNA, uruchamianie zatrzymanych widełek replikacyjnych, oraz jest istotna dla zachowania struktury telomerów i centromerów. Odgrywa więc bardzo ważną rolę w zachowaniu stabilności genomu, co zapobiega procesowi nowotworzenia u organizmów wyższych.
Rrp1 i Rrp2 to badane przez nas mediatory homologicznej rekombinacji występujące u drożdży Schizosaccharomyces pombe. Należą one, razem z paralogiem Uls1 u drożdży Saccharomyces cerevisiae, do translokaz łączących dwa bardzo ważne szlaki post-translacyjnych modyfikacji białek – SUMOilacji i ubikwitynacji, odgrywające istotną rolę w procesach degradacji, ale także w regulowaniu aktywności białek.
Pokazaliśmy, że Uls1 oraz Rrp1 i Rrp2 biorą udział w odpowiedzi na stres replikacyjny i regulują wybór ścieżki naprawy uszkodzonego DNA. Uls1 oraz Rrp2 odgrywają też rolę w stabilizacji struktury telomerów. Ostatnio wykazaliśmy, że Rrp1 i Rrp2 modulują równowagę między wariantami histonów na chromatynie, co jest istotne dla prawidłowego funkcjonowania centromeru. Funkcje Uls1 oraz Rrp1 i Rrp2 zależą od obecnych w ich strukturze motywów interakcji z SUMO, domeny ATPazowej charakterystycznej dla translokaz, a także domeny RING, charakterystycznej dla ligaz ubikwitynowych.
Pokazaliśmy bezpośrednio, na oczyszczonym preparacie białka, że Rrp1 reguluje aktywność rekombinazy Rad51, gdyż ubikwitynuje ją i usuwa z dwuniciowego DNA.
Obecnie badamy za pomocą obserwacji w mikroskopie fluorescencyjnym oraz immunoprecypitacji interakcji białek Rrp1 i Rrp2 z innymi białkami biorącymi udział w utrzymaniu stabilności genomu. Sprawdzamy też, za pomocą spektrometru masowego, jakie białka ulegają ubikwitynacji i sumoilacji z sposób zależny od Rrp1 i Rrp2.
Kierownik tematu: dr hab. Dorota Dziadkowiec
Doktoranci:
Dorota Misiorna – SUMOilacja i enzymy SUMO-zależne w odpowiedzi na stres replikacyjny u drożdży. Promotor pomocniczy: dr Karol Kramarz.
dr Gabriela Baranowska – Rola DNA zależnych translokaz w utrzymaniu stabilności genomu u Schizosaccharomyces pombe. Obrona 2024.|
dr Jakub Muraszko – Translokaza Rrp1 jako regulator funkcji rekombinazy Rad51 u Schizosaccharomyces pombe. Obrona 2021.
dr Anna Barg–Wojas – Rola mediatorów homologicznej rekombinacji w utrzymaniu integralności centromerów Schizosaccharomyces pombe. Obrona 2019.
dr Karol Kramarz – Rola ortologów Rad5 w naprawie DNA u drożdży Saccharomyces cerevisiae i Schizosaccharomyces pombe. Obrona 2016.
Najnowsze publikacje z udziałem magistrantów i doktorantów:
Baranowska G., Misiorna D., Białek W., Kramarz K., Dziadkowiec D., PLoS One, 2024
Replication stress response in fission yeast differentially depends on maintaining proper levels of Srs2 helicase and Rrp1, Rrp2 DNA translocases.
Kramarz K., Dziadkowiec D., DNA Repair (Amst)., 2022
Rrp1, Rrp2 and Uls1 – Yeast SWI2/SNF2 DNA dependent translocases in genome stability maintenance.
Muraszko J., Kramarz K., Argunhan B., Ito K., Baranowska G., Kurokawa Y., Murayama Y., Tsubouchi H., Lambert S., Iwasaki H., Dziadkowiec D., Nucleic Acids Res., 2021
Rrp1 translocase and ubiquitin ligase activities restrict the genome destabilising effects of Rad51 in fission yeast.
Barg-Wojas A., Muraszko J., Kramarz K., Schirmeisen K., Baranowska G., Carr AM., Dziadkowiec D., J Cell Sci., 2020
Schizosaccharomyces pombe DNA translocases Rrp1 and Rrp2 have distinct roles at centromeres and telomeres that ensure genome stability.
Pozostałe publikacje
Regulacja rekombinazy Rad51 podczas replikacji DNA – rola Srs2 u Schizosaccharomyces pombe.
Społeczne zachowania bakterii Myxococcus xanthus.
Rola czynników wirulencji Borrelia sp. w przebiegu infekcji.
Prace w grupie badawczej dr hab. Anny Krasowskiej, prof. UWr skupiają się na analizie wpływu zmian w błonie komórkowej patogennego grzyba Candida albicans na jego morfologię, metabolizm, wirulencję oraz oporność wielolekową.
Zgodnie z listą priorytetowych patogenów grzybiczych zagrażających w najwyższym stopniu zdrowiu publicznemu, opublikowaną w raporcie światowej organizacji zdrowia (WHO) z końca 2022 roku (WHO fungal priority pathogens list to guide research, development and public health action), grzyby C. albicans znajdują się w grupie patogenów o najwyższym priorytecie. Zaklasyfikowanie tego mikroorganizmu do grupy najgroźniejszych patogenów grzybiczych jest spowodowane częstym występowaniem zakażeń na całym świecie, wysokim wskaźnikiem zgonów na skutek grzybic systemowych (kandydoza rozsiana) oraz niedoborem skutecznych terapii przeciwgrzybiczych (występowanie oporności wielolekowej C. albicans).
Biorąc pod uwagę powyższe aspekty, istnieje realna potrzeba poszukiwania nowych antybiotyków oraz terapii mogących skutecznie walczyć z infekcjami grzybiczymi. Celem większości stosowanych w medycynie leków jest biosynteza ergosterolu lub bezpośrednio ta cząsteczka obecna w błonie komórkowej grzyba (odpowiednio: leki azolowe, leki polienowe). Wymienione grupy leków wykorzystują jedną z niewielu różnic pomiędzy komórkami grzyba (obecność ergosterolu) a komórkami gospodarza (obecność cholesterolu).
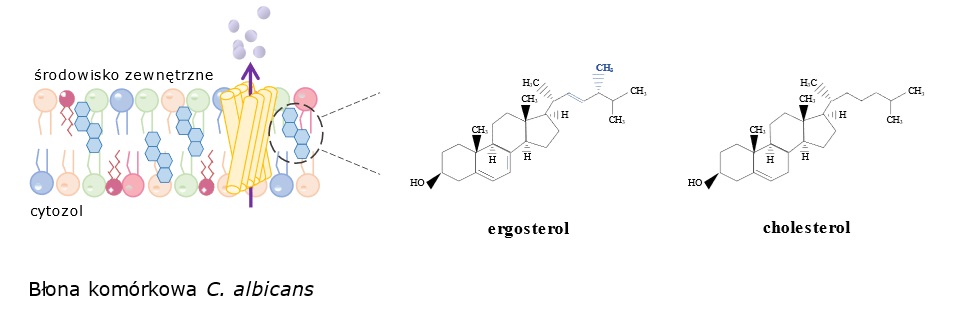
Biorąc pod uwagę powyższe aspekty, istnieje realna potrzeba poszukiwania nowych antybiotyków oraz terapii mogących skutecznie walczyć z infekcjami grzybiczymi. Celem większości stosowanych w medycynie leków jest biosynteza ergosterolu lub bezpośrednio ta cząsteczka obecna w błonie komórkowej grzyba (odpowiednio: leki azolowe, leki polienowe). Wymienione grupy leków wykorzystują jedną z niewielu różnic pomiędzy komórkami grzyba (obecność ergosterolu) a komórkami gospodarza (obecność cholesterolu).
W naszej grupie badawczej analizujemy wpływ tych leków na skład lipidowy błon komórkowych, lokalizację i aktywność transporterów błonowych odpowiedzialnych za wyrzut leków z komórki grzyba oraz ekspresję genów kodujących kluczowe adhezyny i inwazyny (białka odpowiedzialne za pierwsze etapy infekcji grzyba). Posiadamy także obszerną kolekcję szczepów z mutacjami w genach kodujących enzymy szlaku biosyntezy ergosterolu (delecja kluczowych genów, zamiana aminokwasów w sekwencji białka Erg11), które stanowią cenny model w badaniach nad opornością wielolekową C. albicans.
Oprócz antybiotyków stosowanych już w medycynie, poszukuje się także związków pochodzenia naturalnego, które wykazują działanie przeciwgrzybicze, mogące służyć w leczeniu infekcji osobno lub równolegle z terapiami konwencjonalnymi. W naszym zespole badawczym badamy wpływ takich związków na przeżywalność oraz morfologię komórek C. albicans, jak np.: kwas kaprynowy, kwas mlekowy czy ekstrakty z goździka.
C. albicans jest patogenem oportunistycznym. Oznacza to, że do rozwoju infekcji wywołanych przez niego dochodzi w czasie niedoborów odporności gospodarza. Z tego względu, interesujące są także interakcje pomiędzy grzybem a organizmem gospodarza w kontekście odpowiedzi immunologicznej.
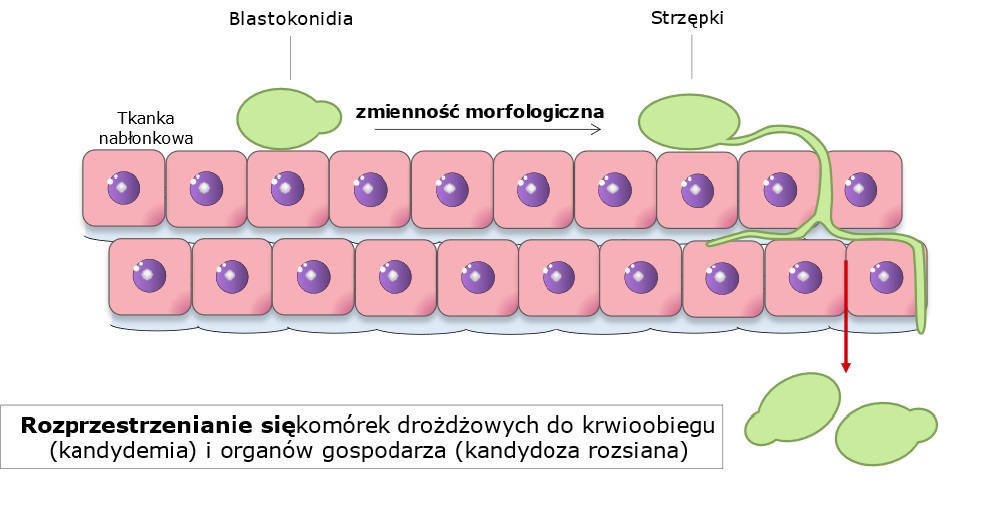
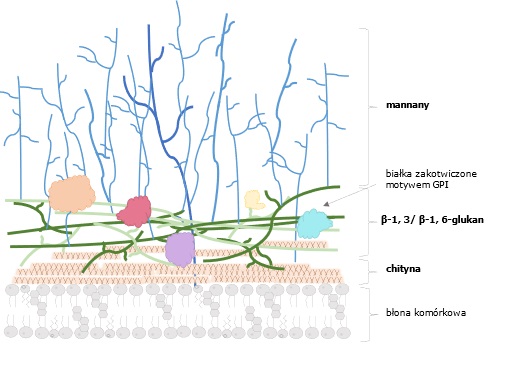
Najnowsze projekty zespołu dotyczą analizy roli sfingolipidów w oporności C. albicans na leki przeciwgrzybicze, wirulencji i odpowiedzi zapalnej oraz komórkowej ludzkich linii komórkowych. Sfingolipidy są cząsteczkami lipidów, obecnymi obok ergosterolu w błonie komórkowej grzyba i odpowiadającymi za przekazywanie sygnałów, prawidłową budowę błony komórkowej, a także za tworzenie mikrodomen. Ostatnie badania wskazują, że sfingolipidy pełnią także rolę w występowaniu oporności na leki przeciwgrzybicze, a modyfikacja szlaków biosyntezy sfingolipidów może prowadzić do zmienionej budowy ściany komórkowej i w konsekwencji rozpoznania patogenu przez układ immunologiczny. Ponadto, C. albicans posiada zdolność do maskowania cząsteczek PAMP przed układem immunologicznym gospodarza poprzez modyfikację budowy ściany komórkowej (ang. cell wall remodeling).
W projekcie realizowanym w naszym zespole zajmujemy się analizą wpływu zmian w biosyntezie sfingolipidów na budowę oraz skład błony i ściany komórkowej, odpowiedź zapalną oraz komórkową ludzkich linii komórkowych.
W projekcie realizowanym przez dr Darię Derkacz analizowany jest wpływ zmian w biosyntezie β-glukanu (kluczowa cząsteczka PAMP, ang. pathogen-associated molecular pattern),obecna w ścianie komórkowej grzyba C. albicans na odpowiedź zapalną oraz komórkową linii komórkowych nabłonka pochwy oraz fibroblastów z dziąsła. Odkryto, że brak lub zwiększenie ilości ergosterolu w błonie komórkowej grzyba powoduje zmianę struktury ściany komórkowej, prowadząc do ekspozycji β-glukanu i chityny na powierzchni komórek. Może się to przyczyniać do różnic w rozpoznawaniu patogenu przez PRRs (pathogen recognition receptors) na komórkach gospodarza i w konsekwencji do zmienionej odpowiedzi immunologicznej.
Doktoranci:
Liliana Cebula – „Zmiany w strukturze błony i ściany Candida albicans, a zapalna i komórkowa odpowiedź immunologiczna. W trakcie realizacji (od 2024), promotor pomocniczy: dr Daria Derkacz.
dr Daria Derkacz – „Rola błony i ściany komórkowej Candida albicans w odpowiedzi zapalnej”. Obrona 2024 – wyróżnienie.
dr Jakub Suchodolski – „Wpływ ergosterolu na aktywność transportera Cdr1 i wybrane parametry błony plazmatycznej u Candida albicans“. Obrona 2020 – wyróżnienie.
dr Joanna Szczepaniak – „Wpływ wybranych czynników na aktywność transporterów ABC Candida albicans”. Obrona 2017 – wyróżnienie.
dr Anna Pawluk (Murzyn) – „Wpływ Saccharomyces boulardii na czynniki wirulencji C. albicans”. Obrona 2010 – wyróżnienie.
dr Ida Szmigiel – „Biotransformacja śruty rzepakowej z wykorzystaniem Bacillus subtilis”. Obrona 2021 – wyróżnienie.
dr Damian Konkol – „Wykorzystanie biotransformowanej śruty rzepakowej w żywieniu drobiu”. Obrona 2022 – wyróżnienie.
Projekt NCN MINIATURA 8, 2024/08/X/N21/00702: „Izolacja i określenie struktury β-glukanu pozyskanego ze ściany komórkowej szczepów Candida albicans z zaburzoną syntezą ergosterolu oraz ocena wpływu β-glukanu na odpowiedź zapalną i komórkową”, (2024-obecnie).
Kierownik projektu: dr Daria Derkacz.
Projekt NCN OPUS 22, 2021/43/B/NZ1/00523: „Rola sfingolipidów błony plazmatycznej Candida albicans w potencjalnie nowym mechanizmie lekooporności i w odpowiedzi zapalnej”, (2022-obecnie).
Kierownik projektu: dr hab. Anna Krasowska, prof. UWr.
Projekt NCN PRELUDIUM, 2017/25/N/NZ1/00050: „Rola fruktozy w odporności wielolekowej Candida albicans”, (2018-2021).
Kierownik projektu: dr Jakub Suchodolski.
Projekt NCN OPUS 12, 2016/23/B/NZ1/01928: “Zmiany w lekooporności i wirulencji Candida albicans w obecności różnych źródeł węgla”, (2017-2021).
Kierownik projektu: dr hab. Anna Krasowska, prof. UWr.
Najnowsze publikacje z udziałem magistrantów i doktorantów:
Derkacz D., Grzybowska M., Cebula L. and Krasowska A., (2023) Int. J. Mol. Sci, 24(24), 17499
Surfactin and capric acid affects the posaconazole susceptibility of Candida albicans strains with altered sterols and sphingolipids biosynthesis.
Sztafrowski D., Muraszko J., Jasiura A., Bryk P., Urbanek A.K. and Krasowska A., (2023), PloS One
The alternating magnetic field depending on the hydrophobicity of the strain affects the viability, filamentation and sensitivity to drugs of Candida albicans.
Starosta R., de Almeida R.F.M., Suchodolski J., Derkacz D., Krasowska A., (2023), Journal of Inorganic Biochemistry
Anticandidal Cu(I) Complexes with Neocuproine and 1-(4-Methoxyphenyl)Piperazine Based Diphenylaminomethylphosphine: Is Cu-Diimine Moiety a Pharmacophore?
Derkacz D. and Krasowska A., (2023), Int. J. Mol. Sci., 24, 3966
Alterations in the level of ergosterol in Candida albicans’ plasma membrane correspond with changes in virulence and result in triggering diversed inflammatory response.
Urbanek A.K., Łapińska Z., Derkacz D. and Krasowska A., (2022) Pathogens, 11, 1289
The role of ERG11 point mutations in the resistance of Candida albicans to fluconazole in the presence of lactate.
Pozostałe publikacje
1. Wpływ wybranych ekstraktów roślinnych na Candida albicans.
2. Synergiczny wpływ posakonazolu oraz kwasu kaprynowego na wybrane szczepy Candida albicans.
3. Wpływ czynników zmieniających ścianę komórkową Candida albicans na przeżywalność tego grzyba.
4. Synergistyczna aktywność posakonazolu z wybranymi związkami przeciw Candida albicans.
5. Analiza oddziaływania kaspofunginy na morfologię komórek Candida albicans i wpływu na odpowiedź zapalną ludzkich linii komórkowych.
Izolacja i charakterystyka biosurfaktantów
Niektóre mikroorganizmy: bakterie, drożdże, grzyby wytwarzają związki powierzchniowo czynne – biosurfaktanty. Są to związki o różnej budowie chemicznej – niskocząsteczkowe – glikolipidy, lipopeptydy i cykliczne peptydy lub wysokocząsteczkowe – np. lipopolisacharydy, biopolimerowe kompleksy i lipoproteiny.
W Zakładzie Biotransformacji wyizolowano szereg bakterii i grzybów z próbek wody i gleby Spitsbergenu. Te drobnoustroje należą do psychrotolerantów i nie rosną w temperaturach powyżej 30°C. Posiadają szeroki wachlarz uzdolnień metabolicznych, m.in. wydzielają do środowiska biosurfaktanty.
Określono strukturę chemiczną biosurfaktantu (nazwanego pseudofaktyną) wydzielanego przez szczep arktyczny Pseudomonas fluorescens BD5. Jest to lipopeptyd, obniżający napięcie powierzchniowe z 72 mN/m do 31.5 mN/m przy stężeniu of 72 mg/l. Stabilność oraz indeks emulsyfikacji pseudofaktyny są wyższe niż Tween 20 czy Triton X-100.
Stwierdzono również przeciwadhezyjne właściwości pseudofaktyny przeciw mikroorganizmom uropatogennym. Badany biosurfaktanty zapobiega przyleganiu drobnoustrojów do powierzchni szklanych, plastikowych i silikonowych. Oprócz tego, odrywa od tych powierzchni już powstałe biofilmy.
Celem badań prowadzonych w Zakładzie Biotransformacji jest identyfikacja nowych zastosowań biosurfaktantów oraz opracowanie technologii wydajnej ich produkcji w skali przemysłowej.
Bochynek M., et al. 2023 „Centrifugal partition chromatography as a potential method of isolation and purification of amphiphilic substances from a solid-state fermentation process”. Biomass Conv. Bioref. 13:16333.
Bochynek M., et al. 2023 „Formation and structural features of micelles formed by surfactin homologues”. Front. Bioeng. Biotechnol. 11:1211319.
Wójtowicz K., et al. 2021 „Surfactin cyclic lipopeptides change the plasma membrane composition and lateral organization in mammalian cells”. Biochimica et Biophysica Acta, 1863:183730.
Biniarz P., Henkel M., Hausmann R., Łukaszewicz M. 2020 „Development of a Bioprocess for the Production of Cyclic Lipopeptides Pseudofactins With Efficient Purification From Collected Foam”. Front Bioeng Biotechnol 8: 565619.
Biniarz P., Łukaszewicz M., Janek T. 2017 „Screening concepts, characterization and structural analysis of microbial-derived bioactive lipopeptides: a review”. Crit Rev Biotechnol 37(3):393–410.
Izolacja, identyfikacja oraz charakterystyka właściwości biomedycznych biosurfaktantów – rozprawa doktorska.
Biogaz i Metanogeneza
Rozwijanie odnawialnych źródła energii jest palącą potrzebą współczesnej cywilizacji. Jednym z takich źródeł jest biogaz będący produktem biologicznego rozkładu materii organicznej w warunkach beztlenowych. Proces produkcji biogazu jest zjawiskiem złożonym wymagającym współpracy wielu gatunków mikroorganizmów. Zakład Biotransformacji dysponuje stanowiskiem badawczym do prowadzenia fermentacji metanowej w warunkach laboratoryjnych oraz sprzętem do podstawowej analizy surowców stosowanych do produkcji biogazu.
Kluczową rolę w tworzeniu metanu (około 50% biogazu) stanowią archeony. Znajdują się na końcu beztlenowego łańcucha pokarmowego i są kluczowe dla jego stabilnego funkcjonowania. Pomimo ich ważnej roli w ekosystemach beztlenowych, do tej pory wyizolowano jedynie około 170 gatunków tych mikroorganizmów, a wiele aspektów ich funkcjonowania w dalszym ciągu pozostaje niezbadanych. Na podstawie zebranych danych widać jednak, że rodzina archeonów metanogennych stanowi grupę bardzo zróżnicowaną pod względem budowy morfologicznej, uzdolnień metabolicznych oraz preferowanych warunków środowiskowych. W zakładzie Biotransformacji opracowano internetową bazę danych (PhyMet 2) zawierającą szczegółowy opis sklasyfikowanych archeonów metanogennych, która stanowi dogodne narzędzie do gromadzenia i analizy danych o mikroorganizmach potencjalnie przydatnych przemysłowo. Jedną z cech archeonów o potencjalnym znaczeniu dla przemysłu jest obecność struktur zewnątrzkomórkowych zwanych archaella. W przypadku niektórych gatunków archaella są odpowiedzialne za aktywny ruch komórek (Methanospirillum hungatei). Geny kodujące białka budujące archaella są powszechne również u gatunków u których nie zaobserwowano zdolności ruchu. Jedną z możliwych funkcji archaella w tym przypadku może być przewodnictwo elektryczne umożliwiające wymianę elektronów z otoczeniem lub innymi mikroorganizmami.
Prace badawcze prowadzone w Zakładzie Biotransformacji w temacie matanogenezy mają za zadanie zwiększenie wydajności przemysłowej produkcji biogazu oraz zgłębienie molekularnych mechanizmów komórkowych kluczowych dla funkcjonowania archeonów metanogennych.
Meserszmit M., et al. 2024 „Effect of mowing versus abandonment of mesic grasslands in Central Europe on biomass use for biogas production: Implications for semi-natural ecosystem conservation”. J Environ Manage 368:122132.
Burdukiewicz M., et al. 2018 „PhyMet 2 : a database and toolkit for phylogenetic and metabolic analyses of methanogens”. Environ Microbiol Rep 10(3):378–82.
Gaworski M., et al. 2017 „Enhancing biogas plant production using pig manure and corn silage by adding wheat straw processed with liquid hot water and steam explosion”. Biotechnology for Biofuels 10:259
Jabłoński S., et al. 2015 „Continuous mesophilic anaerobic digestion of manure and rape oilcake – Experimental and modelling study”. Waste Management 35:105
Jabłoński S., et al. 2014 „Mathematical modelling of methanogenic reactor start-up: Importance of volatile fatty acids degrading population”. Bioresource technology 174:74
Modelowanie procesu fermentacji metanowej z wykorzystaniem ADM1 – rozprawa doktorska autorstwa Sławomira Jabłońskiego
Identification of methanogenic archaea potentially capable of extracellular enzyme-dependent electron uptake – praca magisterska
Analiza zawartości cukrów rozpuszczalnych i potencjału produkcji biogazu w biomasie wybranych gatunków traw – praca licencjacka
Saccharomyces cerevisiae w badaniach metabolomicznych
Drożdże z rodzaju Saccharomyces są grupą organizmów ważną zarówno z przemysłowego jak i naukowego punktu widzenia. S. cerevisiae są szeroko wykorzystywane w przemyśle z uwagi na swoje uzdolnienia do prowadzenia fermentacji alkoholowej. Wytwarzają alkohol zarówno w celach spożywczych jaki i technicznych. Mogą również stanowić źródło takich produktów jak: alkohole wyższe (np. izobutanol), biomasa wykorzystywana w celach paszowych, ekstrakt drożdżowy, czy składniki prebiotyków (β-glukan). S. cerevisiae są jednym z organizmów szeroko wykorzystywanych w heterologicznej produkcji białek. Trwają również prace nad opracowaniem szczepów dedykowanych do szczególnych zadań np. fermentacji alkoholowej biomasy lignocelulozowej.
S. cerevisiae są ważnym eukariotycznym organizmem modelowym. Pomimo znacznej ilości prac badawczych skupionych na analizie tego mikroorganizmu w dalszym ciągu pozostaje wiele niewyjaśnionych zagadnień z nim związanych. Dla około 10% genów pochodzących z S. cerevisiae nie określono do tej pory funkcji, a mapa metaboliczna wciąż zawiera wiele luk.
W zakładzie Biotransformacji prowadzimy badania mające na celu opracowanie technologii wytwarzania produktów z wykorzystaniem drożdży lub ich biomasy oraz poszerzenie wiedzy dotyczącej metabolizmu S. cerevisiae w szczególności dotyczącego produkcji lotnych związków aromatycznych i przetwarzania aminokwasów hydrofobowych. Doświadczenia prowadzimy na bazie kolekcji szczepów drożdży pochodzących ze środowiska naturalnego oraz uzyskanych na drodze mutagenezy indukowanej promieniowaniem UV. W doświadczeniach korzystamy z technik 1H-NMR (we współpracy ze specjalistami z Politechniki Wrocławskiej) oraz chromatografii GC/MS (z Uniwersytetem Przyrodniczym we Wrocławiu).
Jabłoński S.J., Mielko-Niziałek K.A., Leszczyński P., Gasiński A., Kawa-Rygielska J., Młynarz P., et al. 2024 „Examination of internal metabolome and VOCs profile of brewery yeast and their mutants producing beer with improved aroma„. Sci Rep 14(1):14582.
Łukaszewicz M., Leszczyński P., Jabłoński S.J., Kawa-Rygielska J. 2024 „Potential applications of yeast biomass derived from small-scale breweries” Applied Sciences 14(6):2529.
Selekcja drożdży o zwiększonej produkcji estrów aromatycznych na potrzeby przemysłu piwowarskiego – praca magisterska
Charakterystyka wybranych szczepów Saccharomyce cerevisiae pod kątem wykorzystania w przemyśle – praca magisterska
WYPOSAŻENIE NAUKOWE
Zakład dysponuje dobrym zapleczem do badań biotechnologicznych i mikrobiologicznych wyposażonym w sprzęt taki jak:
- Spectrofluorymetr Hitachi FL 4500
- Mikroskop fluorescencyjny Carl Zeiss Axio Imager A2
- Ultrawirówka CS150FNX z rotorem kątowym
- Czytnik wielodetekcyjny na mikropłytki (UVM 340, ASYS HITACH/BIOGENET)
- Czytnik płytek wielodołkowych Tecan Spark z możliwością inkubacji i hodowli; odczytu absorbancji, fluorescencji, luminescencji oraz kamerą
- QuantStudio™ 3 Real-Time PCR System
- Homogenizator FastPrep-24 5G (M.P. Biomedicals, LLC)
- Piec muflowy (do 1100 °C) LE 2/11/R6 (Nabertherm GmbH)
